| Die Belousov Zhabotinsky Reaktion
Florian Wodlei, Mihnea Hristea |
||||||||||||||||||||||||
| Auszug aus der Jahresarbeit: " Entropie und Musterentstehung in biologischen Systemen", Florian Wodlei, 2002, Waldorfschule Klagenfurt, Mentor. Mihnea Hristea
Bei der Belousov-Zhabotinsky-Reaktion handelt es sich um eine Form der chemischen Oszillation. „Bei oszillierenden chemischen Systemen kann man drei Hauptgruppen unterscheiden: biologische (enzymatische), heterogene und homogene Systeme. Enzym-Reaktionen laufen oft in Schüben ab. Beispiele hierfür sind etwa der Dunkelprozess der Photosynthese oder die Glykolyse. Hier entstehen die für eine Oszillation erforderlichen Rückkopplungen z.B. durch Produkthemmung (Autoinhibition). Bei heterogenen oszillierenden Systemen handelt es sich meist um Elektrodenprozesse oder um Reaktionen an ionenleitenden Membranen. Homogene chemische Oszillatoren, wie die Belousov-Zhabotinsky-Reaktion (BZR) basieren auf autokatalytischen Reaktionssystemen, die aus mehreren gekoppelten Reaktionsschritten bestehen, wobei sich alle Teilnehmer im selben Aggregatszustand befinden. Die Teilreaktionen sind derart gekoppelt, dass die Produkte einer Reaktion eine andere hemmen oder erst ermöglichen. Somit enthalten die Systeme positive und/oder negative Rückkopplungen. Chemische Reaktionen können in unterschiedlichen Geschwindigkeiten ablaufen. So gibt es etwa sehr schnelle Vorgänge, wie Explosionen oder über längere Zeit verzögert ablaufende Reaktion, wie die Landoldt’sche Zeitreaktion. Aber all diese Reaktionen gehen kontinuierlich von einem Ausgangszustand in einen Endzustand über. Oszillierende Reaktionen ändern ihren Zustand hingegen rhythmisch, während sie ablaufen, was man zum Beispiel an einem periodischen Farbwechsel erkennen kann. Die Belousov-Zhabotinsky-Reaktion war das erste homogene oszillierende System, das genauer untersucht wurde. Es wurde eher zufällig von dem Russen Boris Pavlovich Belousov entdeckt. Seitdem wurden viele weitere Beispiele für oszillierendes Verhalten in chemischen Systemen gefunden. Dazu zählen etwa Chlorit-Oszillatoren, oder oszillatorisch ablaufende Oxidationen (z.B. von Kohlenmonoxid oder Wasserstoff) auf Platin-Aluminium-Katalysatoren. Die Belousov-Zhabotinsky-Reaktion basiert auf der Bromierung von Malonsäure.“[i] „Es handelt sich dabei eigentlich um eine Klasse von Reaktionen, bei denen in jedem Fall eine Dicarbonsäure durch Bromat in saurer Lösung oxidiert wird, wobei als oszillierender Katalysator ein Redoxsystem anwesend ist, dessen oxidierte und reduzierte Form sich nur um eine Oxidationsstufe unterscheiden. Solche Systeme sind z. B. Ce(III)/Ce(IV), Mn(II)/Mn(III) oder Fe(phen)33+ /Fe(phen)32+.“[i]
Versuchsdurchführung
Räumliche Oszillation
Benötigte Geräte: Erlenmeyerkolben mit Schliff und Stopfen Die Lösungen I-V Petrischale (25 cm Ø) Destilliertes Wasser
Nach der Erstellung der oben genannten Lösungen (LI – LV) wird nun gewartet bis die Lösung V (mit Schwefelsäure) auf Zimmertemperatur abgekühlt ist (alle Lösungen sind durchsichtig). jetzt kommen hintereinander Lösung II bis IV in den Erlenmeyer. Anschließend kommt auch Lösung I in den Kolben. Bei dieser Zugabe entsteht Brom, der Kolben wird deshalb geschlossen und geschüttelt bis die gelb-braune Bromfarbe verschwunden ist. Nachdem das Brom reagiert hat, wird die Lösung V hinzugefügt. Das entstandene, jetzt rote - wegen des Ferroins - in eine Petrischale, 0,5-2mm, hoch gießen. Diese Schale möglichst ruhig gelagert (mit Kork abfedern).
Beobachtung
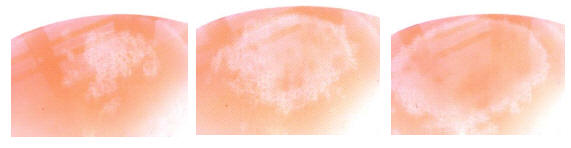
Nach dem Zusammenfügen aller Lösungen, ist die Endlösung erst einmal rot gefärbt, wegen des Ferroin. Nach kurzer Zeit (zwischen 2 bis 3 Minuten) beginnen sich auf der Oberfläche Muster zubilden, die sich über diese ausbreiten. Die Oszillation dauerte bei uns eine halbe Stunde.
Entstehung der räumlichen Muster (zeitlicher Verlauf von Rechts nach links; Aufnahme der Fotos innerhalb einer Minute) (die Fotos sind digital aufbereitet, d.h. Helligkeit und Kontrast angepasst)
Zeitliche Oszillation
Benötigte Geräte: Erlenmeyerkolben mit Schliff und Stopfen Die Lösungen I-V Petrischale (25 cm Ø) Destilliertes Wasser
Die oben genannten Lösungen (L I, II, III, IV) werden mit 7 ml Wasser zusammen in den Erlenmeyer gegeben und verschlossen. Es wird nun gewartet bis die Farbe des Broms verschwunden ist. Nachdem also das Brom reagiert hat, die Lösung V hinzufügen. Diese Lösung nun ständig rühren. Jetzt kann man mit den potentiometrischen Messungen beginnen (unter ständiger Rührung der Lösung).
1.1.2.1. Beobachtung
Nach dem Zusammenfügen aller Lösungen, ist die Endlösung erst einmal rot gefärbt, durch das Ferroin. Nach kurzer Zeit (unter 2 Minuten) färbt sich die ganze Lösung in ein leichtes blau, das anschließend wieder in rot umschlägt. Diese Oszillation dauerte meist mehrere Stunden. Die durchschnittliche Periodendauer der farblichen Oszillation beträgt 14 Sekunden. Das entspricht einer Frequenz von 0,071 Hz.
Potentiometrische Datenaufzeichnung
Die aufgezeichneten Werte gehen anstatt kontinuierlich zu einem Minimum, oszillatorisch auf und ab.
Erklärungsmodell
Man kann dieses nichtkontinuierliche oszillatorische Verhalten zurückführen auf die Nichtlinearität der Differentialgleichungen der Stoffkonzentrationen, die diesem System zugrunde liegen: Die Lösung des Gleichungssystems für die chemischen Reaktionen. Dabei ist der Grund für die Chaosentstehung (wenn die Anzahl der Attraktoren zu unendlich strebt) ist die Nichtlinearität dieser Gleichung. Man kann als Ansatz Problem von Feigenbaum nehmen, wenngleich dieses System viel komplizierter ist.
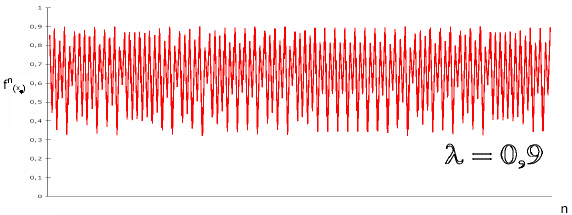
Problem von Feigenbaum Gegeben ist die Funktion f: [0,1] mit Werten aus [0,1] durch die folgende Formel:
f(x)=-4l(x2-x) Sei der Anfangswert xo< 0,5 Es stellt sich die Frage welcher der Grenzwert von ist, wenn f unendliche Male iteriert[1] wird. Graphisch würde die Lösung dieses Problems folgendermaßen aussehen: Stellt man den Weg der Iteration in einem Diagramm dar so stellt sich ein oszillierender Charakter um den/die Attraktor(en) ein:
Für l = 0,9 gibt es schon eine unüberschaubar große Zahl an Attraktoren.
[1] Eine Iteration (lat. für Wiederholung) ist das wiederholte Einsetzen in eine Gleichung (http://www.uni-klu.ac.at/~gossimit/lv/usw00/w/g5/k5julman/LinkIteration.html)
Weiterführende Quellen [i] KRIEGER Jan: Die Belousov-Zhabotinsky-Reaktion:Messung und Simulationsmodelle, http://www.jkrieger.de/bzr/jufo.pdf, 2001: S. 2-3 [ii] Freudenberg Stefan: Die Belousov-Zhabotinsky-Reaktion, http://www.kkgwhv-schule.kwe.de/kkg_chem/ag_allg/bz-reakt/bz-reakt.htm, 1997 [iii] Schunk A.: Experiment des Monats, http://www.chemie.uni-ulm.de/experiment/edm0598.html, 1998: S.1 |